
今回はこういった疑問に答えていきます。
このページでは、現役理系国立大学生が
「気液平衡」について、解説していきます。
演習問題も設けましたので、
是非自分で解いてみて下さい!
気液平衡って何?
気液平衡の解説に入る前に、ひとつ例を出しておきたいと思います。
コップに水を入れてしばらく部屋に置いてくと、
中の水は少しずつ減っていきますよね。
これは世間一般的に知られていることですが
実は、気液平衡の現象だったりします。
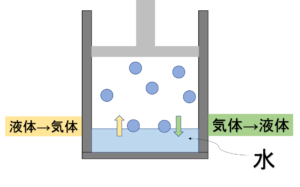
容器の中に液体(今回は水)を入れて放置しておくと、
「液体→気体になる水分子の量」と
「気体→液体になる水分子の量」が
等しくなります。
そうなると見かけ上は、
液体として存在している量と
気体として存在している量は
変化していないように見えます。
この状態を気液平衡といいます。
↓気液平衡状態の様子
しかし気液平衡の状態から、体積が変化すると
このバランスは崩れてしまいます。
気液平衡から体積増加すると
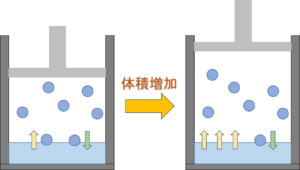
↑のように気液平衡の状態から
体積が増えると、
「液体→気体になる水分子の量」が増えます。
そしてしばらく時間がたつと、
その体積で気液平衡の状態になります。
気液平衡から体積減少すると
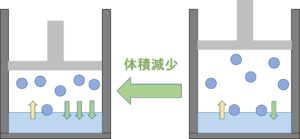
↑のように気液平衡の状態から
体積が減少すると、
「気体→液体になる水分子の量」が増えます。
体積が増加した場合と同様に、
しばらく時間がたつと、
気液平衡の状態になります。
個人的な考え方
私は以下のようなイメージで覚えていました。
参考までに載せておきます。
・体積の分だけ座席があり、
気液平衡状態では座席は全てうまっています。
(用意された座席すべてに水分子(人)が座っている)
・体積が増えると座席数が増え、
増えた座席に座るために、新たに気体の水分子が増える。
・体積が減ると座席数が減り、
座席に座れなくなった人(水分子)が、
気体でいられなくなり、
液体の水が増える(座席は常に全て埋まっている)
問題を解くときに注意すること
問題を解くときに気を付けなければいけないのは、
「飽和水蒸気圧(飽和蒸気圧)」です!
例えばある条件の中で、「水蒸気の圧力を求めよ」
という問題で、気体の状態方程式を用いると
圧力が求められます。
しかし、その計算値が飽和蒸気圧(問題文で示される)
よりも大きい場合は、
答えは飽和蒸気圧となります。
計算から圧力を求める際は、
必ず問題文に書かれている飽和蒸気圧を確認しましょう。
※飽和蒸気圧はその物質と温度によって決まります。
演習問題
問題① 5.0Lの容器にヘキサン0.080molを入れ、30℃に保ちしばらく放置した。 この時のヘキサンの圧力を求めよ。※気体定数を8.31×10³Pa・L/(mol*K)、 30℃でのヘキサンの飽和蒸気圧を3.0×10⁴Paとする。
問題② 問題①で用いたヘキサンのうち、液体として存在している質量は何gか? ※ヘキサンが全て気体として存在している場合は、0gと答えよ。 また、ヘキサンの分子量は86g/molとする。
演習問題の解答
①の解答
ヘキサンが全て気体だと考えたときの圧力をP’〔Pa〕とすると、
理想気体の状態方程式から
P’×5.0=0.080×8.31×10³×303
P’=40286.88≒4.0×10⁴〔Pa〕 となり、
P’>飽和蒸気圧(3.0×10⁴〔Pa〕)なので、
答えは3.0×10⁴ Paとなる。
(ヘキサンの一部は液体)
②の解答
①より、容器内のヘキサンの一部は液体として存在する。
ヘキサンすべての物質量(0.080mol):液体のヘキサンの物質量Xmol
=4.0286×10⁴Pa:(4.0286×10⁴-3.0×10⁴)Pa より、
X=0.080×(4.0286×10⁴-3.0×10⁴)/4.0286×10⁴
=0.020572mol(液体のヘキサンの物質量)
ここにヘキサンの分子量86g/molをかけると、
0.020572×86=1.769192≒1.8g
よって、求める質量は1.8gとなる。



コメント