こんにちは、カガクラムです。
今回は、ハーバー・ボッシュ法について
歴史的な背景なども踏まえながら
解説していきたいと思います。
ハーバー・ボッシュ法とは
ハーバー・ボッシュ法とは、
20世紀初頭に確立された
アンモニアの工業的製法です。
先に反応式と熱化学方程式を載せておきます。
反応式:
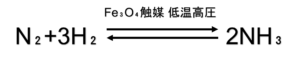
熱化学方程式
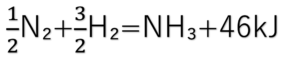
反応条件ですが、
触媒は四酸化三鉄Fe₃O₄ ←(定期テスト,模試出るかも)
圧力は最大100気圧(1気圧=1.013×10⁵Pa)
温度は400~600℃となっています。
ここまでは高校の無機化学の範囲を
一通り見ていきました。
ここからはもう少し深く、
ハーバー・ボッシュ法について
みていきましょう。
反応条件について
触媒
ハーバー・ボッシュ法の触媒は、
先ほども述べたように四酸化三鉄(Fe₃O₄)ですが、
適切な触媒を見つけるまで、
フリッツ・ハーバーさんが
何千回も実験しています。
その中で、コスト面、耐久面でバランスの取れた
四酸化三鉄を採用しました。
シンプルな反応に見えますが、
実用化までには数多の困難がありました。
温度について
温度が400℃~600℃で、
これは比較的低温となっていますが、
これはルシャトリエの原理で説明できます。
※ルシャトリエの原理では、
この反応は圧力を上げれば反応は右へ進み、
(アンモニアが生成する)
発熱反応なので温度を上げれば、
反応は左へ進行します。
(アンモニア→窒素+水素の方向)
なので低温で反応させるほど、
アンモニアが生成するということになります。
しかし反応物が化学反応を起こすためには、
活性化エネルギーよりも大きなエネルギーを加える
必要があるため、温度が低すぎると逆に反応が起こりません。
つまり温度は高すぎず、かつ活性化エネルギーを超える
熱量を与えなければならないので、
比較的低温で反応を進行させています。
圧力の問題
先ほどのルシャトリエの原理では、高圧の方が
アンモニアが生成しやすいことを示しました。
しかし実際に反応させる際には、
持続的に使える製造装置が必要になります。
理論的には圧力は高ければ高い方がよいのですが、
十分に高い圧力を出す装置や工場を作るのは、
当時の技術では困難でした。
その困難を乗り越え、工場の開発設計を成し遂げたのが、
カール・ボッシュさんでした。
歴史的背景
この製法が確立したのは20世紀初頭ですが、
実は19世紀末期、
ヨーロッパで人口が急増します。
人口が増えるとその分食料も必要になります。
しかし、すぐに食料を増やすこともできず、
当時のヨーロッパは
深刻な食糧難に襲われてしまいます。
食料、こと農作物を増やすのに重要になってくるのは
ずばり「肥料」です。
そして肥料には窒素化合物が必要となります。
なので、アンモニアを大量に安く作る必要性が、
高まっていったんですね。
まとめ
今回は、ハーバー・ボッシュ法について
少し詳しい部分まで解説してみました。
触媒の四酸化三鉄Fe₃O₄は、
テストや模試で問われるかもしれませんので、
覚えておきましょう。
一見とてもシンプルな反応ですが、
実際に工場を作り実用化されるまで、
多くの人の努力があったことを
知っていただけたかと思います。
最後まで読んでいただきありがとうございました。


コメント