
こんにちは、カガクラムです。
今回は、大学化学では最も有名かもしれない
「シュレーディンガー方程式」について、
初学者向けに解説していきます。
シュレーディンガー方程式は何を表しているのか?
シュレーディンガー方程式とは、一般に
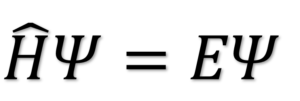
で表される方程式です。
パッと見ても意味わからんと思いますが、
これが何を表しているか示していきたいです。
上記の式ですが、微分方程式を表しています。
Ψという関数をH(^がつく)で微分すると、
E(ある粒子のエネルギー)とΨの積
となることを表しています。
例として、
①y=x²をxで微分すると
②y’=2x となりますよね。
ここでいう①の過程が、
シュレーディンガー方程式の
左辺にあたります。
Ψはyのように関数であり、H(^)は微分記号
のようなものです。
では右辺は何を表しているかというと、
左辺の微分の結果を表しています。
Eは粒子の全エネルギー、Ψは左辺と同じものです。
先ほどの例ではyが微分でy’へと
変わっていますが、
シュレーディンガー方程式では
微分の前後でyの部分(Ψ)が変わりません。
Ψって何よ??
具体的には、Ψは
![]() のxの部分をもっと複雑にしたような関数です。
のxの部分をもっと複雑にしたような関数です。
(またθの部分をxの関数として、
オイラーの公式
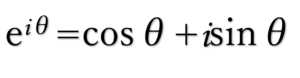
を用いると、三角関数で表すことができます。
三角関数って重要ですね…笑)
e^xのような関数をxで微分しても、
![]() は残りますよね。
は残りますよね。
このような条件を満たしているのが、
Ψなのです。
またEは定数であり、変数xなどを
含まないものです。
Ψって何なのか
関数的な意味でのΨの性質は明らかになりましたが、
実は化学的に重要な意味を持っています。
Ψは「波動関数」と言われ、
|Ψ|²が「確率密度」や「確率分布」などと呼ばれ、
粒子がある空間に存在する確率を表します。
ここでいう粒子とは、
大学の化学分野では一般に
電子を表します。
つまり、|Ψ|² は電子がある領域で
どれくらいの確率で存在するのか
を表します。
大学化学では、
Ψよりもこの|Ψ|² が重要になります。
というのも高校化学では、
電子は原子核の周りを飛び回っている、
と習ったと思いますが、大学では
少し違うイメージをした方がいいと思います。
大学化学では電子は
ほとんどの場合、
どこにいるか正確に把握することは
できません。
しかし、
シュレーディンガー方程式を近似的に
解くと、どこら辺によくいるかが
分かる、というイメージです。
まとめ
今回は、シュレーディンガー方程式
が何を表しているのか、
あたりについてまとめてみました。
シュレーディンガー方程式は
水素原子の場合にしか
正確には解けませんが、
次はそれを解いていきたいと思います。


コメント